
近日,中国科学院深圳先进技术研究院合成生物学研究所严飞研究员团队最新成果以“Ultrasound molecular imaging of p32 protein translocation for evaluation of tumor metastasis”为题在线发表于生物材料领域知名期刊Biomaterials。该工作提供了一种实现p32蛋白易位的超声分子成像并以此评估肿瘤转移的新方法。
深圳先进院合成所严飞研究员为该文章的通讯作者,硕士研究生郝永胜和深圳大学硕士研究生罗静娜为该文章的共同第一作者。
文章上线截图
文章链接:https://doi.org/10.1016/j.biomaterials.2022.121974
蛋白质易位是所有活细胞的基本生命过程,一些蛋白质需要在不同的细胞亚区执行其特定的生物学功能,以帮助细胞精确响应不同的生理,病理或环境刺激。一旦某些蛋白质易位的正常过程被突变或者干扰,将可能导致不良后果的发生,例如肿瘤。因此,实现对蛋白质易位的检测对于疾病的诊断、分型乃至治疗都具有重要意义。在过去的几十年中,已经开发出了各种分子检测策略,包括免疫金标记技术,共聚焦显微成像,免疫组织化学染色和流式细胞术。这些方法具有高灵敏度和特异性,但它们仅适用于体外培养细胞或离体组织切片样品。此外,这些方法不能反映体内情况下的实时动态过程。超声分子成像是利用靶向造影剂与细胞表面表达的分子标志物特异性结合以实现其超声成像检测的新技术,能够实现对标志物的在体实时检测,在肿瘤早期诊断,进程及疗效评价方面具有重大的应用前景。然而,传统的微泡造影剂因其微米级别的粒径无法穿过肿瘤血管内皮细胞间隙而被局限于血池成像。
最近,一种由嗜盐古菌合成的气体囊泡(Gas vesicles, GVs)因其优异的超声对比成像和肿瘤血管渗出能力为血管外肿瘤细胞表面标志物的分子检测提供了新的希望。这些生物合成纳米气囊由14个gvp基因编码的蛋白质壳组成,内部包裹空气,平均粒径约为200 nm,可以顺利穿过血管并接触肿瘤细胞,实现对肿瘤细胞标志物动态水平的超声分子成像检测。
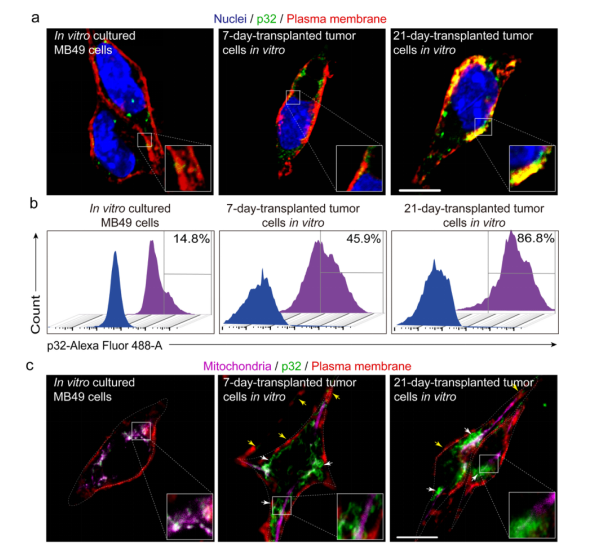
图1. 肿瘤进展过程中p32蛋白细胞膜易位鉴定
p32蛋白是一种重要的肿瘤分子标志物,主要定位于线粒体基质中,有证据表明,p32蛋白在细胞膜上的分布水平是肿瘤细胞恶性转变的一个重要特征,随着肿瘤细胞恶性程度的增加,p32蛋白在细胞表面的表达水平会逐渐增高,可作为肿瘤恶性进展的分子标志物。受这一现象的启发,严飞研究员团队推测p32蛋白可能经历了从线粒体到质膜的易位,且这种易位对肿瘤生长、侵袭和转移产生了重要的促进作用。
研究团队首先对肿瘤p32蛋白的线粒体-质膜易位进行了鉴定,构建了MB49小鼠膀胱癌移植瘤,通过免疫荧光染色和流式细胞术等手段对体外培养的MB49细胞,移植7天后的小肿瘤组织细胞和21天后的大肿瘤组织细胞的p32蛋白在细胞膜和线粒体上的表达变化进行了鉴定。结果表明,当MB49肿瘤细胞从体外培养移植到小鼠体内7或21天时,可以观察到p32蛋白的膜表达水平显著增加(14.8%, 45.9%, 86.8%)(图1a,b)。
为了确认肿瘤细胞表面增加的p32是否来自线粒体,研究人员通过免疫荧光染色进一步检测了p32蛋白在这些肿瘤细胞中的亚细胞定位。结果表明,体外培养肿瘤细胞的p32蛋白主要位于线粒体中,在质膜上几乎检测不到p32蛋白的免疫荧光信号,而在移植7天小肿瘤和21天大肿瘤的肿瘤细胞中,p32蛋白定位在细胞膜上的量逐渐增加(图1c)。这表明随着肿瘤的进展,p32蛋白经历了从线粒体到细胞膜的易位,越来越多的p32蛋白易位到了肿瘤细胞的表面。
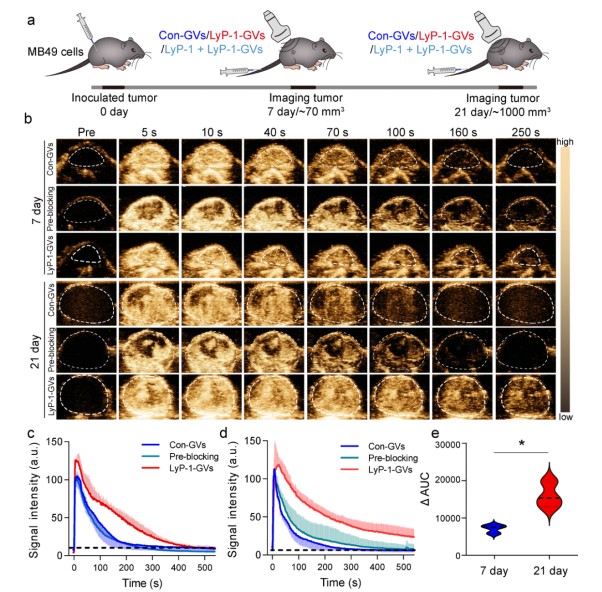
图2. 肿瘤细胞p32蛋白易位的超声分子成像
为了实现肿瘤p32易位的超声分子成像检测,研究人员利用LyP-1靶向多肽通过化学偶联的方法连接到嗜盐古菌合成的气体囊泡表面,制备了靶向p32蛋白的超声分子影像探针LyP-1-GVs,通过向荷瘤小鼠尾静脉分别注射LyP-1-GVs和对照探针Con-GVs,利用临床超声成像诊断设备对肿瘤部位进行超声造影成像。
研究结果表明,相比于对照探针Con-GVs,LyP-1-GVs在移植21天的大肿瘤中的超声分子影像信号持续时间更长,其时间-强度曲线的曲线下面积也更高,其信号与p32蛋白的肿瘤细胞膜表达水平具有良好的线性相关关系,由此成功实现了肿瘤细胞p32蛋白膜易位水平的在体超声分子成像检测。此外,研究人员还进一步分析了p32蛋白易位与肿瘤转移的关系,确认了其与肿瘤的转移行为有关。因此,这项工作提供了一种实现p32蛋白易位的超声分子成像并以此评估肿瘤转移的新方法。
该工作获得了国家科技部重点研发计划项目、国家自然科学基金面上项目、深圳市科创委以及深圳合成生物学创新研究院等项目的支持。
Yongsheng Hao, Jingna Luo, Yuanyuan Wang, Zhenzhou Li, Xiangwei Wang, Fei Yan, Ultrasound molecular imaging of p32 protein translocation for evaluation of tumor metastasis, Biomaterials, 2023. https://doi.org/10.1016/j.biomaterials.2022.121974.